ヒトiPS細胞由来血管化肝臓オルガノイドで免疫抑制薬による血管障害の仕組みを解明
移植医療で使用される薬剤が引き起こす肝臓微小血管障害を世界で初めて可視化
ポイント
- ヒトiPS細胞から作製した血管網を持つ肝臓オルガノイドを免疫不全マウスに移植し、生きたまま血管の動きを観察できる独自の生体イメージング技術を確立。
- 移植医療で広く使用される免疫抑制薬「抗胸腺細胞グロブリン(ATG)」が、肝臓の微小血管障害を二段階で引き起こすことを世界で初めて解明。
- 第一段階は補体(免疫システムの一部)系の過剰活性化による急速な血栓形成、第二段階はTGFβシグナルを介した遅発性の炎症反応であることを特定。
- 本研究で開発した評価プラットフォームは、薬剤性肝障害の機序解明や副作用を軽減する新たな治療法・予防法の開発に貢献することが期待される。
概要
東京科学大学(Science Tokyo)総合研究院 ヒト生物学研究ユニットの河村峻太郎大学院生(博士後期課程)、武部貴則教授(大阪大学 大学院医学系研究科 教授/同ヒューマン・メタバース疾患研究拠点 副拠点長)、自治医科大学 外科学講座の岡田憲樹 助教らの研究グループは、ヒトiPS細胞[用語1]由来の血管網を有する肝臓オルガノイド[用語2]を用いて、免疫抑制薬ATGが引き起こす肝臓微小血管障害のメカニズムを詳細に解明しました。
ATGは、肝臓移植をはじめとする臓器移植後の拒絶反応を抑えるために広く使用されていますが、ときに血栓形成や肝機能障害などの重篤な副作用を引き起こすことが知られています。しかし、その詳細な発症メカニズムは、ヒト肝臓内の血流を再現できる適切なモデルが存在しなかったことから、これまで明らかにされていませんでした。
今回、研究グループは、ヒトiPS細胞由来の肝臓オルガノイドをマウスの脳表に移植し、AIを活用することで生きたまま高解像度でヒト血管の動態を長期間観察できる「生体イメージング[用語3]」技術を確立しました。このシステムを用いてATGを投与したところ、まず補体系がヒト血管内皮細胞上で過剰に活性化し、急速な血栓を引き起こす(第一段階)ことを発見しました。さらに約24時間後には、TGFβ経路が活性化し、好中球(白血球の一種)の集積を伴う遅発性の炎症反応が血管障害をさらに悪化させる(第二段階)ことを明らかにしました。
また、ATGによる肝障害を発症した実際の患者の肝組織を解析したところ、本モデルで観察された現象と一致する病理所見が確認され、本研究の臨床的妥当性が実証されました。
本研究成果は、これまでブラックボックスとされてきたATGによる血管障害のメカニズムに初めて光を当てたものであり、本研究で確立されたモデルは、より安全な免疫抑制療法の開発や、さまざまな薬剤性肝障害の病態解明に貢献する新しいプラットフォームとなることが期待されます。
本成果は、11月6日(米国東部時間)付で「Cell Reports Medicine」誌に掲載されました。
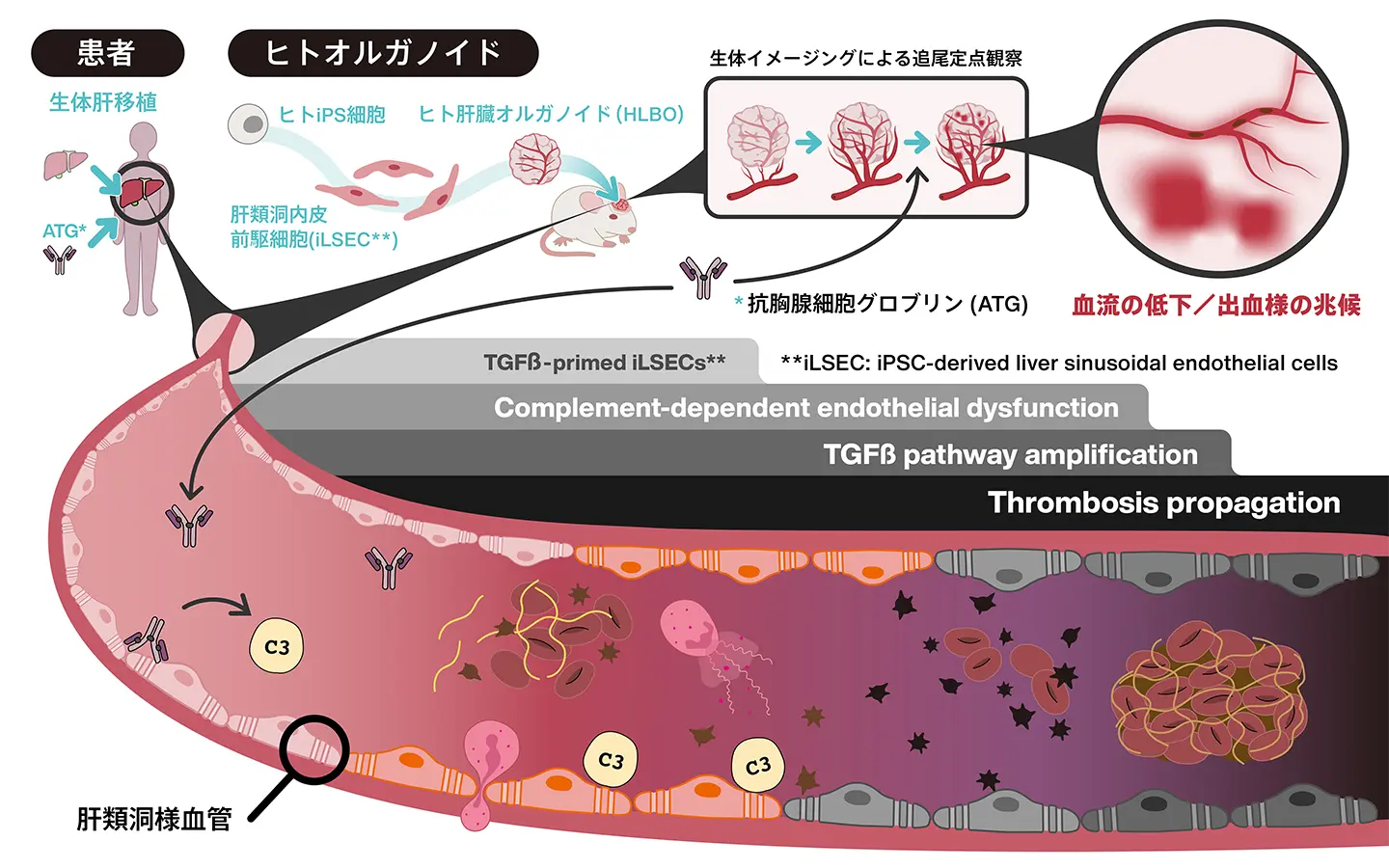
ヒト類洞構造を有する肝臓オルガノイドに、臓器移植後の免疫抑制剤であるATGを投与し、段階的に血栓形成が進行するメカニズムを解明した。
背景
抗胸腺細胞グロブリン(ATG)[用語4]は、臓器移植における拒絶反応の抑制や、移植片対宿主病(GVHD)の治療に用いられる強力な免疫抑制薬です。
その有効性が高い一方で、血小板減少や血栓症、さらに類洞閉塞症候群(SOS)[用語5]と呼ばれる重篤な肝障害を引き起こすことが報告されており、臨床上の課題となっていました。ATGが血管内皮細胞に作用することは示唆されていましたが、特にヒト肝臓内の微細な血管網(類洞)で何が起きているのかを直接観察する手段がなく、その詳細な病態メカニズムは不明のままでした。
研究成果
本研究グループは、ヒトiPS細胞から肝実質細胞、間葉系細胞、血管内皮前駆細胞を自己組織化させて作製した「血管化肝臓オルガノイド(HLBOs)」[参考文献1]を、免疫不全マウスの脳表に移植しました。HLBOに含まれている血管内皮前駆細胞は、脳表で肝臓特異的な血管内皮細胞である肝類洞内皮細胞様に分化(iLSEC)し、肝類洞で生じる血栓症病態が再現可能でした。
脳表は動きが少なく安定しているため、共焦点レーザー顕微鏡を用いることで、オルガノイド内に構築されたヒト由来の血管網の内部を生きたまま高解像度で経時的に観察することが可能です。
このモデルマウスに、臨床で用いられる濃度のATGを静脈注射し、血管内の変化を追跡した結果、以下の二段階の病態が明らかになりました。
第一段階:補体駆動性の急性血栓形成(投与後~6時間)
ATG投与後わずか1時間で、薬剤がヒトiLSEC血管に選択的に結合し、3時間後には免疫防御を担う「補体(C3)」が血管内皮細胞の表面に沈着しました。
これにより血小板が次々と凝集し、微小な血栓が形成されて血流が阻害される様子が観察されました。
この反応はヒトの血管に特異的であり、マウス自身の血管では見られませんでした。さらに、補体の機能を阻害する薬剤をあらかじめ投与したところ、ATGによる血栓形成が有意に抑制されたことから、補体の活性化が初期段階の主たる原因であることが証明されました。
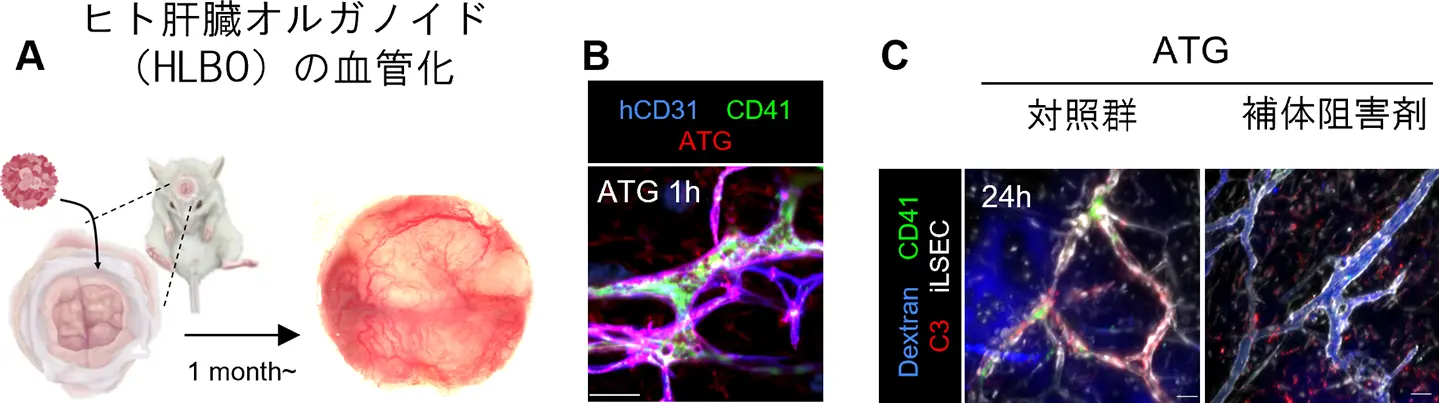
A. マウスクラニアルウィンドウ内で肝臓オルガノイド(HLBO)に含まれるiLSECが血管化した様子。
B. ATG投与1時間後のHLBOで、iLSEC血管(human CD31、青)、血小板(CD41、緑)およびATG(赤)を染色した蛍光画像。
C. ATG投与24時間後に撮影された、対照群と補体阻害剤の投与を比較したライブイメージング像。血液(Dextran、青)、血小板(CD41、緑)、補体C3因子(C3、赤)、およびiLSEC(白)を可視化。
第二段階:TGFβ経路を介した遅発性炎症と血管破綻(投与後24時間)
ATG投与から24時間後、iLSECの遺伝子発現を網羅的に解析した結果、炎症や血栓を促進する複数の遺伝子群(CCL2, SERPINE1など)が活性化していることが明らかになりました。
これらの遺伝子群は、細胞の増殖や線維化に関わる「TGFβシグナル伝達経路」によって制御されていることが判明しました。
実際の生体イメージングでは、このタイミングで好中球がヒト血管に集積し、血管壁が壊れて内容物が漏れ出す「血管破綻」が起きていることが確認されました。
また、TGFβの働きを阻害する薬剤(SB431542)を投与したところ、血栓形成や血流障害が改善したことから、TGFβ経路が病態の悪化に寄与していることが示されました。
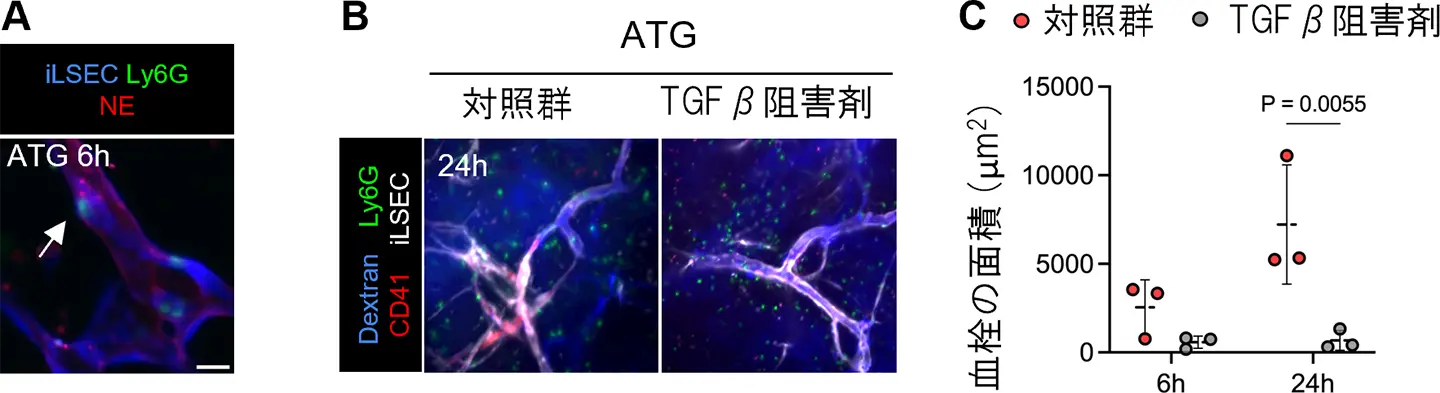
A. ATG投与6時間後に観察された、iLSEC血管(青)に接着した好中球(Ly6G、緑)の好中球エラスターゼ(NE、赤)の放出を示したライブイメージング像。
B. ATG投与24時間後に撮影された、ビークルとTGFβ阻害剤投与下を比較したライブイメージング像。血液(Dextran、青)、好中球(Ly6G、緑)、血小板(CD41、赤)、およびiLSEC(白)を可視化。
C. ATG投与24時間後におけるiLSEC血管内の血栓の面積をビークルとTGFβ阻害剤投与下を比較した定量(平均±SD)。
これらのモデルで得られた発見を検証するため、実際にATG治療後にSOSを発症した患者の肝生検組織を分析したところ、モデルと同様に肝類洞での血栓形成、補体(C4d)の沈着、好中球の集積が確認されました。これにより、本研究で得られた知見の臨床的意義が裏付けられました。
社会的インパクト
本研究は、ヒトiPS細胞由来オルガノイドと生体イメージング技術を組み合わせることで、これまで不可能だった「ヒト臓器における薬剤副作用の動的プロセス」を可視化することに成功しました。
ATGによる肝障害が、「補体による急性の血栓」と「TGFβによる遅発性の炎症」という二段階で進行することを明らかにした本成果は、より安全な投与方法の確立や、副作用を標的とした治療薬の開発につながる重要な知見です。
今後の展開
本研究で構築した評価プラットフォームは、ATGによる肝障害リスクの予測に役立つだけでなく、他の薬剤による肝障害や血栓性微小血管症など、さまざまな血管関連疾患の病態解明や創薬研究にも応用可能な、強力なツールとなることが期待されます。
付記
本研究は、主として、以下の事業の一環で行われました。
-
日本医療研究開発機構(AMED)
- 革新的先端研究開発支援事業「ヒト肝オルガノイドモデルを用いた内分泌系の破綻と炎症・線維化機構の解明」
-
科学技術振興機構(JST)ムーンショット型研究開発事業
- 研究開発プログラム「2050年までに、AIとロボットの共進化により、自ら学習・行動し人と共生するロボットを実現(プログラムディレクター:福田敏男名古屋大学客員教授)」、研究開発プロジェクト「人とAIロボットの創造的共進化によるサイエンス開拓(プロジェクトマネージャー:原田香奈子東京大学教授)」(JPMJMS2033)、研究開発課題「In toto Bio-simulator」
- 研究開発プログラム「2050年までに、超早期に疾患の予測・予防をすることができる社会を実現(プログラムディレクター:祖父江元愛知医科大学理事長・学長)」、研究開発プロジェクト「生体内ネットワークの理解による難治性がん克服に向けた挑戦(プロジェクトマネージャー:大野茂男順天堂大学特任教授)」(JPMJPS2022)、研究開発課題「患者生体データの統合解析と検証に向けた技術開発」
参考文献
- [参考文献1]
- 本年6月に発表した血管構造を持ったヒト肝臓オルガノイドに関する成果:Self-organization of sinusoidal vessels in pluripotent stem cell-derived human liver bud organoids、東京科学大学プレスリリース「iPS細胞からヒト肝臓の類洞血管を再構築」
用語説明
- [用語1]
- iPS細胞(人工多能性幹細胞):皮膚や血液などの体細胞に特定の遺伝子を導入して作製される、体のあらゆる細胞に分化できる能力(多能性)を持つ細胞。本研究では、ヒトiPS細胞から肝臓を構成する複数種類の細胞(肝内胚葉、間葉系、血管内皮前駆細胞など)を分化誘導し、オルガノイドの材料として使用した。
- [用語2]
- 肝臓オルガノイド(Liver Organoid):ヒトiPS細胞から作製された、肝臓の構造や機能を模倣する小型の三次元組織。本研究では、iPS細胞由来の肝細胞と血管系細胞を自己組織化させることで血管網を有する「血管化肝臓オルガノイド」を作製し、マウスに移植することでヒトの肝臓組織を体内で再現した。
- [用語3]
- 生体イメージング(Intravital Imaging):生きた動物の体内で起きている生命現象を、顕微鏡を用いてリアルタイムで観察する技術。本研究では、肝臓オルガノイドをマウスの頭蓋骨に設けた観察窓の下に移植し、オルガノイド内のヒト血管で起こる血栓形成や炎症細胞の動きを、生きたまま高解像度で観察することに成功した。
- [用語4]
- 抗胸腺細胞グロブリン(Antithymocyte Globulin, ATG):臓器移植後の拒絶反応や移植片対宿主病を抑制するために、世界的に広く使用されている免疫抑制薬の一つ。
- [用語5]
- 類洞閉塞症候群(Sinusoidal Obstruction Syndrome, SOS):主に化学療法や高用量の免疫抑制薬などの強い薬剤により、肝臓内の微細血管(類洞)の内皮細胞が障害を受け、血管が詰まることで発症する重篤な肝障害。本研究では、ATGによって引き起こされた血管障害が、このSOSの病態と類似していることを示唆した。
論文情報
- 掲載誌:
- Cell Reports Medicine
- タイトル:
- Modeling antithymocyte globulin-induced microvasculopathy using human iPSC-derived vascularized liver organoids
- 著者:
- Shuntaro Kawamura, Yosuke Yoneyama, Norikazu Saiki, Yunheng Wu, Chiharu Moriya, Rio Ohmura, Mari Maezawa, Yoshihiro Shimada, Yicheng Wang, Kensaku Mori, Noriki Okada, Yasuharu Onishi, Yukihiro Sanada, Yuta Hirata, Yasunaru Sakuma, and Takanori Takebe
研究者プロフィール
武部 貴則 Takanori Takebe
東京科学大学 総合研究院 ヒト生物学研究ユニット 教授
研究分野:再生医学、オルガノイド生物学
関連リンク
お問い合わせ
東京科学大学 総合研究院 ヒト生物学研究ユニット
教授 武部 貴則
- ttakebe.ior@tmd.ac.jp
- Tel
- 03-5803-5795
- Fax
- 03-5803-4157
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661