「悪者」と思われていた鉄が守りの役割を発揮し、肝線維化を抑える新たな仕組みを解明
鉄がCXCL5を介して好中球を呼び込み、線維分解を促進することで胆汁うっ滞性肝疾患の進行を抑制
ポイント
- 肝細胞内の鉄が、胆汁うっ滞性肝疾患において線維化を抑制する役割を持つことを発見した。
- 鉄がCXCL5の発現を増加させ、それにより線維溶解酵素MMP9を産生する好中球の肝臓への集積が促され、線維分解が進む仕組みを解明した。
- 鉄は従来「有害因子」と考えられてきたが、条件によっては線維化を抑制する「保護的作用」を示す可能性があり、新しい治療戦略につながることを示した。
概要
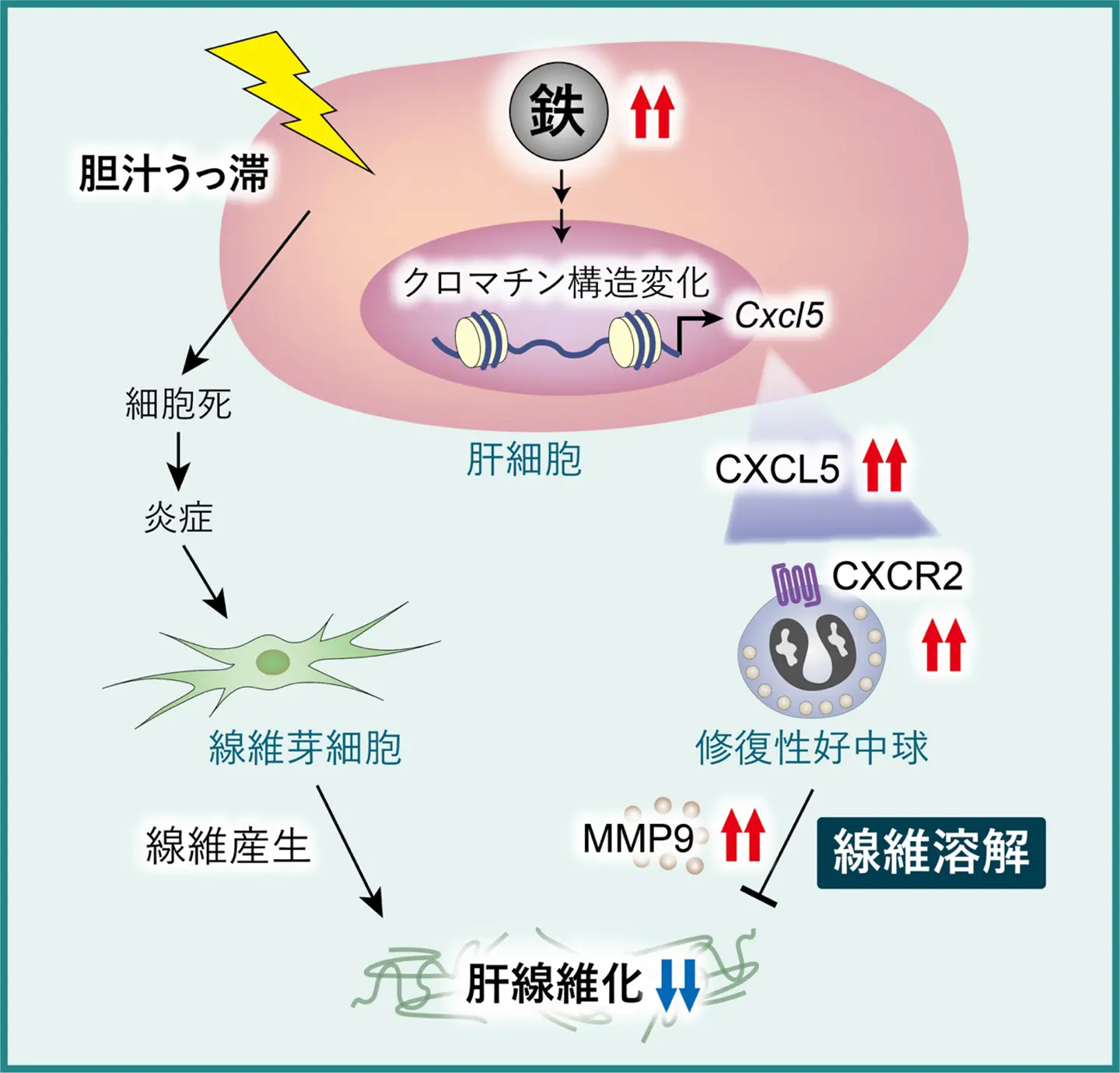
東京科学大学(Science Tokyo)総合研究院 難治疾患研究所 細胞動態学分野の諸石寿朗教授、熊本大学大学院生命科学研究部 分子薬理学講座の金森耀平助教、金沢大学 医薬保健研究域医学系 人体病理学の原田憲一教授らの研究チームは、マウスモデルを用いた解析により、肝細胞内の鉄が胆汁うっ滞性肝疾患における線維化病態を改善することを明らかにしました。これまで肝臓における鉄は、酸化ストレスを介して細胞死を促進し、慢性肝疾患を悪化させる因子と考えられてきました。しかし今回の研究で、肝細胞[用語1]に鉄が蓄積すると、胆汁うっ滞性肝疾患[用語2]における肝線維化[用語3]が抑制される一面があることが示されました。
具体的には、鉄が肝細胞でケモカインCXCL5[用語4]の発現を高め、それによって線維溶解作用を持つMMP9[用語5]陽性の好中球[用語6]の集積が促されました。さらに、患者検体においても、MMP9の発現が高い群では線維化が軽度であることが確認されました。
肝線維化は慢性肝疾患の最終段階として肝硬変や肝不全を引き起こし、生命予後を大きく左右します。これまでの研究では鉄を「有害因子」として捉えることが多かったのですが、本研究はその逆に「保護的作用」を明らかにしました。本成果は、鉄代謝や免疫細胞との相互作用を利用した新しい治療法の開発につながる可能性を示唆しています。今後は、鉄代謝やCXCL5-MMP9経路を標的とした治療法の開発や、患者層別化に基づく個別化医療への応用が期待されます。
本研究成果は、熊本大学 免疫ゲノム構造学講座および東京科学大学 制がんストラテジー研究室との共同研究によって得られ、9月11日(現地時間)付で「JHEP Reports」誌に掲載されました。
背景
慢性肝疾患は、アルコール、ウイルス感染、自己免疫、代謝異常など多様な要因によって進行し、最終的に肝硬変や肝がんを引き起こします。その中でも肝線維化は、肝臓の構造と機能を根本から損なう中心的な病態です。線維化は一方的に進行するだけでなく、線維を分解する「線維溶解反応」も同時に起きています。このバランスが崩れると、肝疾患は重症化します[参考文献1]。
鉄は生体に不可欠な金属であり、エネルギー代謝やDNA合成に必須ですが、過剰に蓄積すると酸化ストレスを介して細胞死を促進します。そのため、これまで肝臓における鉄は「悪役」として認識されてきました。実際、慢性肝炎やアルコール性肝障害では鉄の蓄積が進行を悪化させることが知られています[参考文献2]。
一方、近年の臨床研究では、肝細胞に鉄が沈着している患者の一部で、むしろ線維化が軽度であることが報告されています[参考文献3]
。これは「鉄は肝疾患を悪化させるだけでなく、状況によっては抑制的に働く可能性がある」ことを示唆しています。しかし、その具体的な仕組みは不明のままでした。
そこで本研究では、肝細胞特異的に鉄を増加させたマウスモデルを用い、胆汁うっ滞性肝疾患における鉄の役割を詳細に解析しました。その結果、鉄が好中球の線維溶解機能を活性化し、線維化の抑制に寄与することが明らかになりました。これは従来の常識を覆す発見であり、慢性肝疾患に対する新たな治療戦略につながる可能性を示しています。
研究成果
研究チームはまず、肝細胞に鉄を蓄積させる目的で、鉄を制御する分子であるFBXL5[用語7]を欠損させたマウスを作製しました。このマウスに胆汁うっ滞性肝疾患モデルを誘導するDDC食を投与したところ、対照群に比べて肝線維化が有意に軽減していることがわかりました。興味深いことに、線維を産生する線維芽細胞や、コラーゲン産生遺伝子の発現量は減少していませんでした。つまり、鉄は「線維を作らせない」のではなく、「線維を分解する力を強める」方向に働いていることが示唆されました。
そこで、線維分解に関与する酵素群の発現を解析した結果、特にMMP9の発現が顕著に上昇していました。さらに、MMP9を阻害剤で薬理学的に抑制すると、鉄による線維化抑制効果は減弱しました。すなわち、鉄がMMP9を介して線維分解を促進していることが明らかになりました。
次に、MMP9がどのような細胞から産生されるのかを調べたところ、大部分は好中球由来であることが判明しました。FBXL5欠損マウスの肝臓では、MMP9を発現する好中球が著しく増加しており、鉄が好中球の集積を誘導していると考えられました。さらにメカニズムを探ると、鉄が肝細胞でのCXCL5発現を増強し、それを介してCXCL5の受容体であるCXCR2を持つ好中球を呼び寄せていることがわかりました。クロマチン解析では、鉄によってCXCL5遺伝子領域のクロマチン構造が変化し、発現が促進される「エピジェネティック活性化[用語8]」が起きていることが示唆されました。
さらに、ヒト検体(原発性胆汁性胆管炎患者37例)の解析でも、MMP9の発現が高い患者群では線維化が軽度であることが明らかになりました。これはマウスモデルだけでなく、ヒト疾患においてもMMP9の発現が肝線維化の進行に関与する可能性を示しています。
以上の結果から、肝細胞内の鉄はCXCL5–MMP9経路を介して線維溶解好中球を誘導し、肝線維化を抑制する新しい役割を持つことが示されました。
社会的インパクト
肝線維化が進行すると肝硬変や肝不全に至り、移植以外に根本的な治療法がありません。そのため、「線維化をいかに抑えるか」は医学的に極めて重要な課題です。本研究は、従来「悪者」と考えられていた鉄に、線維化を抑制する作用があることを明らかにしました。さらに、患者検体での解析から、この仕組みが臨床的にも重要な意義を持つ可能性が示されました。将来的には、鉄の動態を調節したり、CXCL5–MMP9経路を標的とした薬剤を開発したりすることで、肝硬変への進行を防ぐ新しい治療戦略につながることが期待されます。
今後の展開
本研究により、鉄が胆汁うっ滞性肝疾患において肝線維化を抑制する新たな仕組みが明らかになりました。ただし、肝疾患には多様な原因や進行様式があるため、このメカニズムが他の疾患にも共通して作用するのかどうかは、今後の重要な研究課題です。たとえば、世界的に患者数が増加している代謝機能障害関連脂肪肝炎(MASH)においても、鉄–CXCL5–MMP9経路が有効に働くかどうかを検証する必要があります。
また、本研究での臨床検体解析は原発性胆汁性胆管炎(PBC)患者を対象に実施されましたが、より大規模な患者群での検討や、性差を含む詳細な解析が求められます。特に、女性に多いPBCと男性に多い原発性硬化性胆管炎(PSC)において、鉄の役割に違いがあるかを明らかにすることは、個別化医療の観点からも極めて重要です。
さらに、将来的な治療応用を目指すうえでは、鉄を直接投与することには酸化ストレスや肝障害の悪化といったリスクが伴います。加えて、鉄の作用は細胞種によって異なる可能性があるため、安全性を確保しながら有益な作用を最大限に引き出す工夫が必要です。たとえば、CXCL5を誘導する肝細胞を標的とした鉄補充療法や、MMP9産生好中球を増加させる薬剤の開発などが一つのアプローチとして考えられます。これらは従来の「鉄は有害」という考え方に一石を投じ、新たな治療選択肢を提示する可能性を秘めています。
加えて、本研究で示された「鉄によるCXCL5発現のエピジェネティックな活性化」については、その分子機構の詳細がまだ十分に解明されていません。鉄がクロマチン構造やヒストン修飾にどのような影響を与えているのかを明らかにすることは、肝疾患研究のみならず、鉄代謝や免疫制御の基礎研究においても新たな知見をもたらすと考えられます。
本研究は、鉄の新たな生理的意義を示すとともに、肝線維化に対する新規治療戦略につながる可能性を提示するものであり、今後の疾患理解と治療法開発の進展に大きく寄与すると期待されます。
付記
本研究成果は日本医療研究開発機構、日本学術振興会、科学技術振興機構、難病医学研究財団、加藤記念バイオサイエンス振興財団、武田科学振興財団の支援を受けて実施したものです。
参考文献
- [1]
- Hammerich L, Tacke F. Hepatic inflammatory responses in liver fibrosis. Nat Rev Gastroenterol Hepatol. 2023;20:633-646. doi: 10.1038/s41575-023-00807-x.
- [2]
- Kowdley KV. Iron, hemochromatosis, and hepatocellular carcinoma. Gastroenterology. 2004;127:S79-86. doi: 10.1016/j.gastro.2004.09.019.
- [3]
- Nelson JE, Wilson L, Brunt EM, Yeh MM, Kleiner DE, Unalp-Arida A, Kowdley KV; Nonalcoholic Steatohepatitis Clinical Research Network. Relationship between the pattern of hepatic iron deposition and histological severity in nonalcoholic fatty liver disease. Hepatology. 2011;53:448-57. doi: 10.1002/hep.24038.
用語説明
- [用語1]
- 肝細胞:肝臓の主要な細胞で、代謝や解毒を担う
- [用語2]
- 胆汁うっ滞性肝疾患:胆汁の流れが障害され、肝臓に炎症や線維化を引き起こす疾患の総称
- [用語3]
- 肝線維化:肝臓にコラーゲンなどの線維成分が過剰に蓄積し、硬くなる病態
- [用語4]
- CXCL5:CXCL5:好中球を呼び寄せるケモカイン
- [用語5]
- MMP9:コラーゲンなどの細胞外マトリックスを分解する酵素
- [用語6]
- 好中球:白血球の一種で、感染防御だけでなく組織修復にも関与する
- [用語7]
- FBXL5:細胞内鉄を制御する分子。欠損すると鉄が過剰に蓄積する
- [用語8]
- エピジェネティック活性化:DNA配列そのものを変えずに、遺伝子の発現を調節する仕組み
論文情報
- 掲載誌:
- JHEP Reports
- タイトル:
- Hepatocyte iron suppresses liver fibrosis via fibrolytic neutrophil recruitment in cholestasis
- 著者:
- Yohei Kanamori, Akihiro Nita, Keiichi I. Nakayama, Daisuke Kurotaki, Kenichi Harada, Toshiro Moroishi
研究者プロフィール
諸石 寿朗 Toshiro Moroishi
東京科学大学 総合研究院 難治疾患研究所 細胞動態学分野 教授
研究分野:分子生物学、細胞生物学
金森 耀平 Yohei Kanamori
熊本大学 大学院生命科学研究部 分子薬理学講座 助教
研究分野:栄養学、病態医化学
原田 憲一 Kenichi Harada
金沢大学 医薬保健研究域医学系 人体病理学 教授
研究分野:肝臓病理学
関連リンク
取材申込み
東京科学大学 総務企画部 広報課
- media@adm.isct.ac.jp
- Tel
- 03-5734-2975
- FAX
- 03-5734-3661