ポイント
- ウイルス感染を阻害し、副作用がなく安全で使いやすい薬を開発する戦略を実施。
- 変異を繰り返すウイルスのスパイクに結合する天然のアミノ酸のみからなるペプチドを設計。
- 軽症から重症までの感染者に対して強い薬効を示すペプチドを開発。
- 治療薬としてだけでなく予防としても使用可能なペプチド医薬候補。
- 化学合成が容易で、安価かつ大量供給が可能な直鎖状の短い構造形成ペプチド製剤を開発。
- 構造創薬技術を用いて短期間での開発と改良を実現。
- 室温での高い安定性と水溶性を有し、品質管理が容易。
- 多くの国や地域に供給可能で、パンデミックに備えることができる。
概要
東京科学大学(Science Tokyo)※ 総合研究院 高等研究府 細胞構造生理学研究室の藤吉好則特別栄誉教授と中村駿プロジェクト助教らと大阪医科薬科大学 医学部 微生物学・感染制御学教室の研究チームは、武漢株からオミクロン株の亜種[用語1]XBB.1.5までのすべての変異ウイルスに強い抗ウイルス活性を持つ、安全なペプチド医薬候補を開発しました。
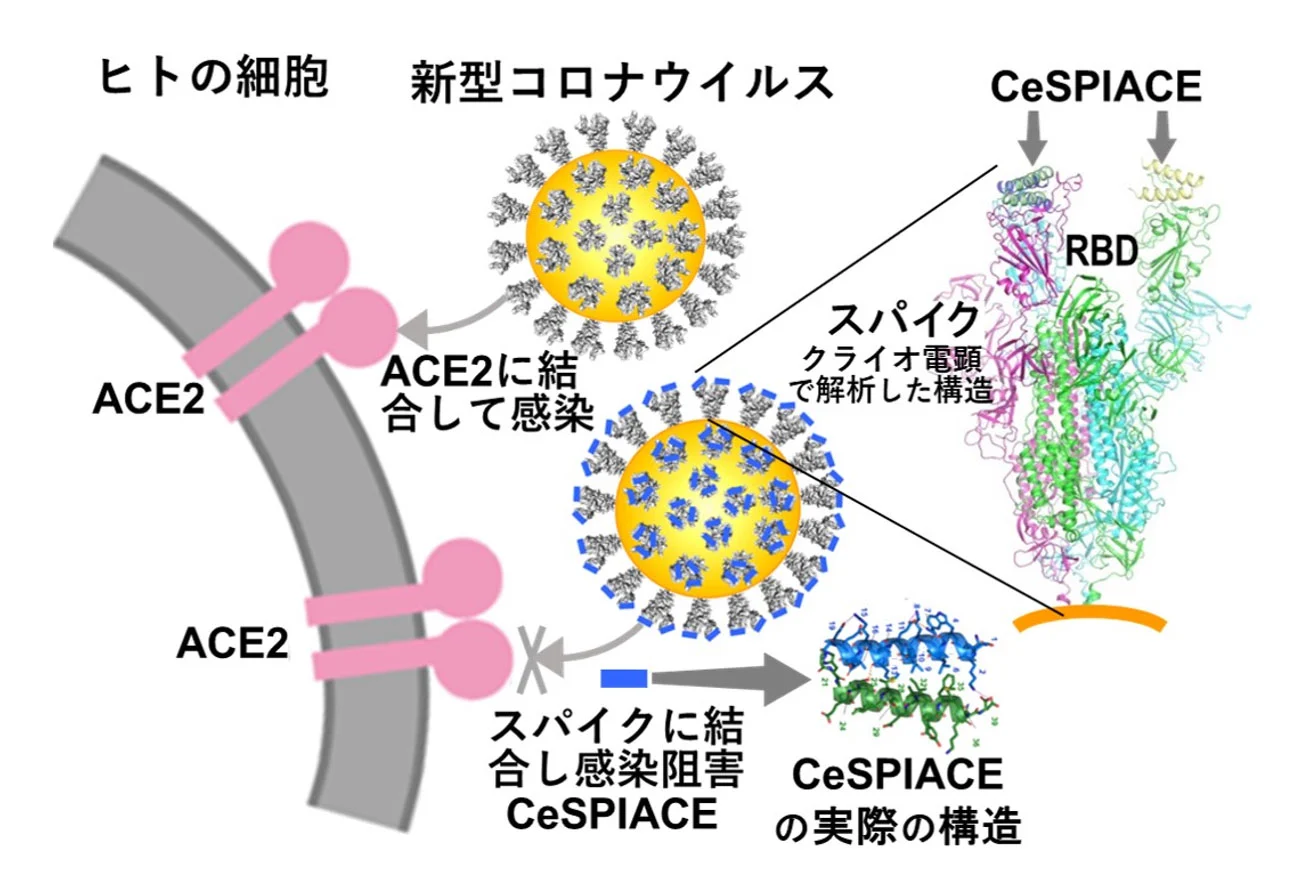
ウイルスが感染する際に細胞に取り付くスパイク[用語2]だけに特異的に結合して感染を防げば、人体に悪い影響を与えることのない理想的な薬になることが期待されます。しかし、この創薬戦略は、変異によるスパイクの表面構造の変化に弱いという問題が存在します。この問題を、クライオ電子顕微鏡などの構造解析技術[用語3]を活用することで克服し、1種類で全ての変異ウイルスに強い抗ウイルス活性を持つペプチド医薬候補の開発に成功しました。
このペプチド医薬候補は、化学合成が容易な短いペプチド[用語4]であり、天然のアミノ酸からなる直鎖状の短い構造形成ペプチド[用語5]です。またこのペプチドは特異的にウイルスのスパイクのみに結合するため、副作用がありません。さらに、軽症から重症まで幅広い感染者に対して、併用禁忌[用語6]の心配なく安全に投与できる、強力な新型コロナウイルス治療薬候補です。しかも、保存方法についてもこのペプチドは室温でも長期間安定しており、世界中に届けることが可能で、パンデミックにも備えることができます。加えて、この技術は、インフルエンザなどの他の感染症に対する治療薬の開発にも応用できると期待されます。
本成果は、1月24日付(米国東部現地時間)の「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」に掲載されました。
- 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
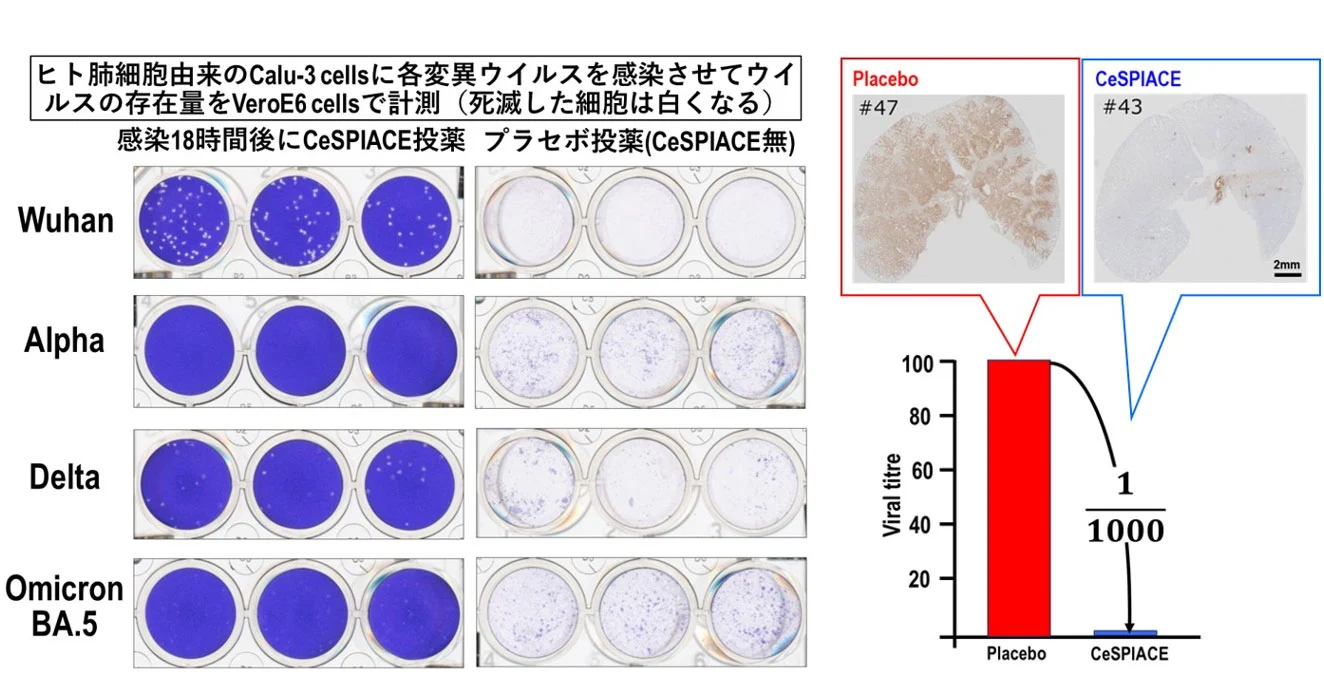
(右)デルタ株を感染させたハムスターを用いた実験で、CeSPIACEを含まないプラセボでは肺一面にウイルスが感染しているが、CeSPIACE投与によりウイルスがほとんど見られなくなるほど高い治療効果があることが病理解剖の結果から確認された(右上)。ウイルスRNAを測定した結果、1/1,000にウイルス量が減っていることが確認された(右下)。
背景
新型コロナウイルスなどの感染症は、社会や経済活動に大きな影響を与えています。実際、今世紀においては、2002〜2003年にSARSが、2009年にインフルエンザが、2012年にMERSが、そして2019〜2023年には新型コロナウイルスが大流行しました。
ワクチンや治療薬などが開発されてきたものの、理想的な治療薬としては、ヒトの身体に影響を与えることなく、ウイルス感染を強く阻害し、副作用が全くない安心して投薬できる薬が望まれています。
そのための創薬戦略として、SARS-CoV-2ウイルスが、ACE2(Angiotensin-Converting Enzyme 2:アンジオテンシン変換酵素2)に結合するスパイクタンパク質の先端に存在するRBD(Receptor Binding Domain:受容体結合ドメイン)に強く結合する阻害剤を開発することが考えられます。しかし、RBDがACE2に結合する接触面には、低分子が結合できるポケットが存在しないため、ペプチド製剤を用いてPPI(Protein-Protein Interaction:タンパク質間相互作用)を制御する必要があります。さらに、新型コロナウイルスなどの変異ウイルスではスパイクタンパク質が繰り返し変異を起こすため、すべての変異ウイルスのスパイクに強く結合できる阻害剤が求められます。そこで、東京科学大学で高度化してきている構造解析技術を活用して、本研究グループは、この課題に挑戦しました。
研究成果
副作用がなく、安心して使用できる薬の開発を目指し、構造創薬(SGDD: Structure-Guided Drug Development)技術を用いてペプチド医薬候補の開発に成功しました。具体的には、変異を繰り返すウイルスであっても、感染に必要なACE2への結合を阻害することを目指しました。
RBDがACE2に結合するのと同じRBD部分に強く結合し、解離しない天然のアミノ酸のみで構成される構造形成ペプチドを設計しました。この開発したペプチドは、武漢株からオミクロン株のXBB.1.5までのすべてのタイプの新型コロナウイルスに強い薬効を示し、CeSPIACE(COVID-19 eliminative Short-Peptide Inhibiting ACE2 binding)と命名されました。
このペプチドは39アミノ酸からなる短い直鎖状であり、容易に化学合成ができます。同じ長さの2本のヘリックスから成る束を形成し、ヘリックスを巻いた後に塩橋などでその構造を安定化します。また、RBDへの結合面を外側に向けるようにホモ2量体を形成し、4本のヘリックスからなるさらに安定な束の構造を形成するように設計されています。この基本構造を保持しながら、ACE2への結合に必要不可欠なRBDのアミノ酸と強く結合できるように設計しました。
変異を繰り返すウイルスのRBDでも、その主鎖の構造は変化しない(主鎖の構造が変わるとACE2に結合できず感染できない)ことが確認できましたので、RBDの主鎖との結合を強化するようCeSPIACEを設計しました。このペプチドは、特定の変異RBDに特に強く結合するのではなく、変異を繰り返すRBDのすべてに結合できるよう、変異の影響を受けにくい設計が施されています。
実験では、武漢型、アルファ型、デルタ型、オミクロン株(BA.1、BA.2、BA.5)のRBDに対するCeSPIACEの解離定数(KD値)を測定した結果、1 nM以下の強い結合能を確認しました。また、感染細胞を用いた抗ウイルス活性の半数阻害濃度(IC50)は10nM以下で、強い抗ウイルス活性を確認しました。さらに、ヒト肺細胞由来のCalu-3細胞を用いた実験でも、多様な変異ウイルスに対して強い抗ウイルス活性を確認しました。加えて、シリアンハムスターを用いた動物実験では、プラセボ条件と比較してウイルスRNA量を1/1,000に減少させる顕著な抗ウイルス活性を確認しました。
社会的インパクト
新型コロナウイルスの感染状況や、ワクチン・治療薬開発の状況を踏まえ、ウイルス感染を強力に阻害し、副作用がなく安全で使いやすい薬の必要性を感じたことから、本研究の開発を開始しました。これまでのパンデミックに間に合う形で治療に使えるようにはできませんでしたが、当初の創薬戦略で掲げた「副作用がなく、躊躇なく安心して使用できる薬」を開発するという目標に基づき、候補物質としてペプチド医薬CeSPIACEを開発することに成功しました。このCeSPIACEは、変異を繰り返してもヒトのACE2に結合して感染するすべてのウイルススパイクに対応可能な構造形成ペプチドです。天然のアミノ酸のみで構成されているため、副作用の懸念がなく、軽症から重症までの感染者に対しても強い薬効が期待されます。
さらに、CeSPIACEは治療薬としてだけでなく予防薬としての利用も可能であり、抗体薬に比べて安価に大量供給が可能です。これは、化学合成が容易な直鎖状の短い構造形成ペプチドであることに加え、構造創薬技術を活用することで短期間での開発と改良が可能になったことによる成果です。また、室温での高い安定性と優れた水溶性を備えた物性により、品質管理が容易で、多くの国や地域に供給可能です。
このような特性を持つCeSPIACEは、将来のパンデミックへの備えとして大きな社会的意義を持つだけでなく、世界中の感染症治療に新たな希望を提供する可能性を秘めています。
今後の展開
新型コロナウイルスに対する治療薬として開発されたペプチドCe172(CeSPIACE)は、東京科学大学と株式会社CeSPIAの共同特許が申請されています。また、東京科学大学の若林健二教授らとの共同研究により、急性呼吸窮迫症候群(ARDS)にも顕著な効果があることが確認されており、副作用がなく、軽症から重症まで幅広い感染者に対して投薬すれば高い薬効が期待される治療薬候補となっています。
今後、この構造形成ペプチド医薬について医師主導の治験を実施し、人への投薬を可能な限り早期に実現したいと考えています。さらに、インフルエンザウイルスなど他の感染症にも、この創薬戦略を応用することで有効な治療薬の開発が可能と期待されており、既にその開発を開始しています。
付記
この研究は、経済産業省生物化学産業課の支援を受けて実施されました。また、AMED(日本医療研究開発機構)の「新興・再興感染症に対する革新的医薬品等開発推進研究事業」(JP21fk0108462、JP21fk0108585)、「次世代治療・診断実現のための創薬基盤技術開発事業」(JP21ae0121028、JP18ae0101046)、科学研究費助成事業 基盤研究(A) (20H00451)などの支援を受けて実施されました。
用語説明
- [用語1]
- オミクロン株の亜種:新型コロナウイルスは変異を繰り返しているが、アルファからミューまでの変異株では数か所であったRBDにおける変異が、その後現れたオミクロン株のBA.1からは、15ヵ所程もの変異を示すようになった。それゆえ、代表的な亜種としてBA.1, 2, 5, XBB.1.5について、CeSPIACEの結合能を測定した。
- [用語2]
- スパイク:新型コロナウイルスはその表面にスパイクと呼ばれる突起を形成している。それは3量体を形成して、先端のRBDでヒトの細胞のACE2に結合することで感染する。なお、免疫系の抗体分子はこのスパイクを認識することによって感染を防ごうとするので、それを逃れるためにスパイクは変異を繰り返す傾向にある。
- [用語3]
- クライオ電子顕微鏡などの構造解析技術:スパイクに強く結合して感染を防ぐ治療薬を構造創薬(SGDD: Structure-Guided Drug Development)技術によって開発するためには、スパイクやRBDの構造を高い分解能で解析する必要がある。実際に阻害剤候補ペプチドがスパイクのエクトドメインに結合した構造はクライオ電子顕微鏡法で、RBDに結合した構造はX線結晶学で構造解析することによって、効率良く治療薬開発や改良を行うことができる。
- [用語4]
- 化学合成が容易な短いペプチド:中和抗体が新型コロナウイルスの治療に威力を発揮したが、変異に対応する必要があることに加えて、生物製剤のために製造コストが高いという問題が生じている。今回開発した構造形成ペプチド製剤、CeSPIACEは、39アミノ酸からなる短い直鎖状ペプチドなので、容易に化学合成ができて、生物製剤より製造コストを飛躍的に低くできる。
- [用語5]
- 構造形成ペプチド:構造創薬技術によって、スパイクのRBDに強く結合して、強い抗ウイルス活性を有するペプチド製剤を開発するには、ヘリカルバンドルなどのように、安定な構造を形成しているペプチドでなければならない。このような構造形成ペプチドで治療薬を設計しているので、変異が生じた場合にも構造情報に基づいて効率良く、短期間に改良を行うことができる。
- [用語6]
- 併用禁忌:薬を投薬するときに、別の薬を服用していると重篤な副作用が生じる恐れがあるので、薬を併用して投薬することができないことを示している。
論文情報
- 掲載誌:
- Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)
- 論文タイトル:
- Structure-guided engineering of a mutation-tolerant inhibitor peptide against variable SARS-CoV-2 spikes
- 著者:
- Shun Nakamura, Yukihiro Tanimura, Risa Nomura, Hiroshi Suzuki, Kouki Nishikawa, Akiko Kamegawa, Nobutaka Numoto, Atsushi Tanaka, Shigeru Kawabata, Shoichi Sakaguchi, Akino Emi, Youichi Suzuki, Yoshinori Fujiyoshi
研究者プロフィール
中村駿 Shun NAKAMURA
東京科学大学 総合研究院 高等研究府 細胞構造生理学研究室 プロジェクト助教
研究分野:薬学、構造生物学

藤吉好則 Yoshinori FUJIYOSHI
東京科学大学 総合研究院 高等研究府 細胞構造生理学研究室 特別栄誉教授
研究分野:構造生理学

鈴木陽一 Youichi SUZUKI
大阪医科薬科大学 医学部 微生物学・感染制御学教室 講師
研究分野:ウイルス学
関連ページ
お問い合わせ
東京科学大学 総合研究院 高等研究府 細胞構造生理学研究室
特別栄誉教授 藤吉好則
- Tel
- 03-5803-4359
- Fax
- 03-5803-0453
- yoshi.cesp@tmd.ac.jp
取材申込み
東京科学大学 総務企画部 広報課
- Tel
- 03-5734-2975
- Fax
- 03-5734-3661
- media@adm.isct.ac.jp