ポイント
- 非ウイルス性肝がんにおいて、ACVR2A[用語1]の発現低下が解糖系[用語2]および乳酸産生を亢進させ、免疫抑制的な腫瘍微小環境を形成することで、予後不良因子となることを解明。
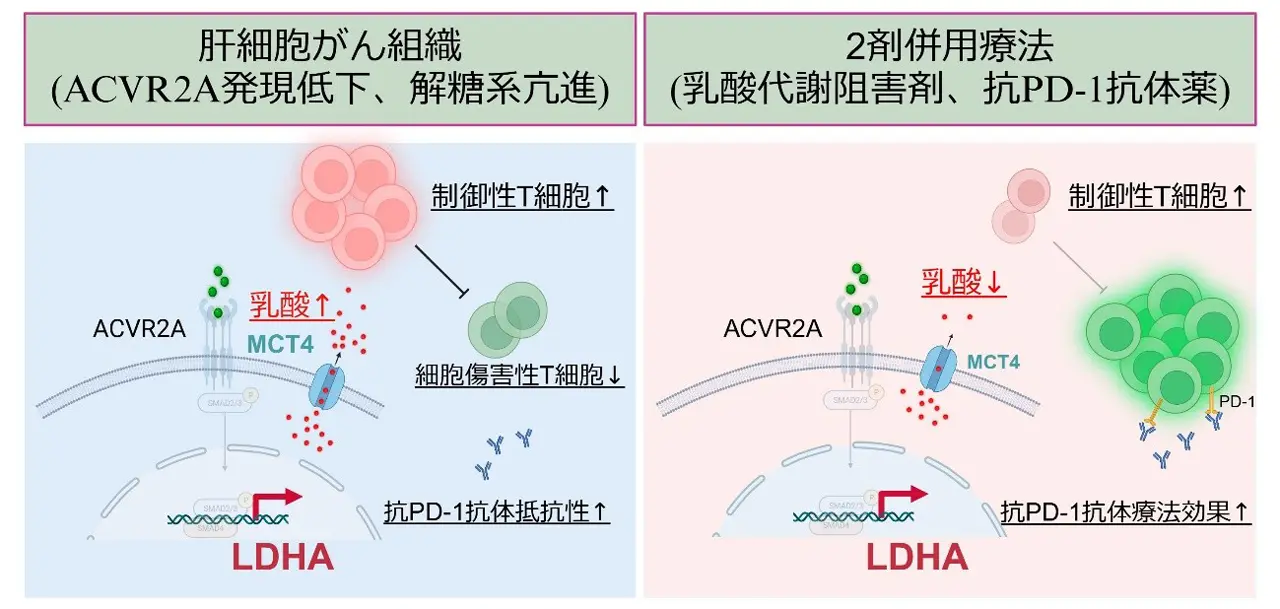
- ACVR2Aの発現低下により、LDHA[用語3]およびMCT4[用語4]の発現が上昇し、乳酸産生と分泌が増加。その結果、Treg細胞[用語5]の浸潤が促進され、抗PD-1抗体に対する抵抗性を獲得することを確認。
- MCT4阻害剤と抗PD-1抗体の併用により、腫瘍内の乳酸濃度が低下し、Treg細胞の浸潤が抑制されるとともに、免疫治療の効果が増強されることを示唆。これにより、乳酸代謝を標的とした新たな治療戦略の可能性が示された。
概要
東京科学大学(Science Tokyo)大学院医歯学総合研究科 分子腫瘍医学分野の安川紘矢大学院生、島田周助教、田中真二教授らの研究グループは、同大学 肝胆膵外科学分野および信州大学 消化器・移植・小児外科学分野との共同研究において、以下の成果を明らかにしました。
非ウイルス性肝がんにおいて、アクチビンA受容体2A(ACVR2A)の異常が高頻度に認められ、それが予後不良因子であることを明らかにしました。さらに、ACVR2Aの発現低下が乳酸脱水素酵素A(LDHA)の発現を促進し、乳酸の産生と分泌を増加させることで、腫瘍内に高乳酸環境を形成することを見出しました。この高乳酸環境は、制御性T細胞(Treg細胞)の腫瘍内浸潤を引き起こし、抗PD-1抗体療法[用語6]への抵抗性を高める要因となることが確認されました。
さらに、マウスモデルを用いた実験により、乳酸トランスポーター(MCT4)を薬理学的に阻害すると、腫瘍内の乳酸濃度が低下し、Treg細胞の腫瘍内浸潤が抑制され、細胞傷害性T細胞[用語7]が活性化することが明らかになりました。また、MCT4阻害剤と抗PD-1抗体を併用することで、顕著な抗腫瘍効果を発揮し、免疫療法への抵抗性を克服する新たな治療戦略となる可能性が示唆されました。
本研究成果は、2025年3月25日(米国時間)付の「Cell Reports Medicine」電子版に掲載されました。
背景
肝がん(肝細胞がん)は、肝炎ウイルス、アルコール、生活習慣病に伴う代謝異常などがリスク要因として知られています。田中教授のグループではこれまでに、非ウイルス性肝がんでは制御性T細胞(Treg細胞)の浸潤が多いことを報告しています[参考文献1]。また、肝がんにおいてTreg細胞の浸潤が予後不良に関与し、免疫治療抵抗性に寄与することが報告されています。しかし、その分子メカニズムや具体的な解決策については、これまでほとんど解明されていませんでした。
研究成果
肝がん臨床検体を用いてアクチビンA受容体2A (ACVR2A)の発現を評価した結果、非ウイルス性肝がんでは体細胞変異や発現低下が多く認められました。さらに、ACVR2Aの発現が低下している組織では、Treg細胞の浸潤が有意に多く、細胞傷害性T細胞の浸潤が有意に少ないことが確認されました。また、非ウイルス性肝がんにおいてACVR2Aの発現が低い患者は、全生存期間が有意に短く、ACVR2Aが予後を予測する有望なバイオマーカーとなる可能性が示唆されました。
肝がん細胞株でACVR2Aをノックアウト[用語8]し、遺伝子発現解析を行ったところ、乳酸脱水素酵素A(LDHA)遺伝子を筆頭に、解糖系・低酸素・血管新生に関与する遺伝子の発現が亢進していることが明らかになりました。実際に、ACVR2Aノックアウト肝がん細胞株の培養上清、細胞内、さらには腫瘍内において乳酸濃度が有意に上昇し、乳酸の蓄積がTreg細胞の浸潤を誘導することも確認されました。この現象は、腫瘍細胞が産生・放出する乳酸がTreg細胞を誘導することを示したWatsonらの報告[参考文献2]とも一致しており、ACVR2Aに異常がある肝がんが高乳酸環境を介して抗腫瘍免疫を回避する可能性を示唆しています。
そこで、本研究グループは乳酸の制御が治療の鍵となると考え、乳酸トランスポーターであるMCT4に着目しました。ACVR2Aの発現が低下し、解糖系が亢進している肝がんではMCT4の発現が有意に亢進していたため、MCT4阻害剤(VB124)の投与実験を行いました。その結果、MCT4阻害剤の単独投与でも有意な腫瘍抑制効果が認められ、さらに抗PD-1抗体と併用すると、より強い抗腫瘍効果を示しました。MCT4阻害剤の投与により、腫瘍内の乳酸濃度は低下し、Treg細胞の浸潤が減少するとともに、細胞傷害性T細胞の浸潤が増加していることが明らかになりました(図1)。
さらに、ヒト肝がん臨床検体を用いた免疫染色により、LDHA高発現および解糖系の亢進をPET-CT検査[用語9]で同定できることが明らかになりました。この結果から、PET-CT検査で陽性となった肝がん患者に対し、MCT4阻害剤と抗PD-1抗体を併用することで、免疫療法の抵抗性を克服する新たな治療戦略となる可能性が示唆されました。
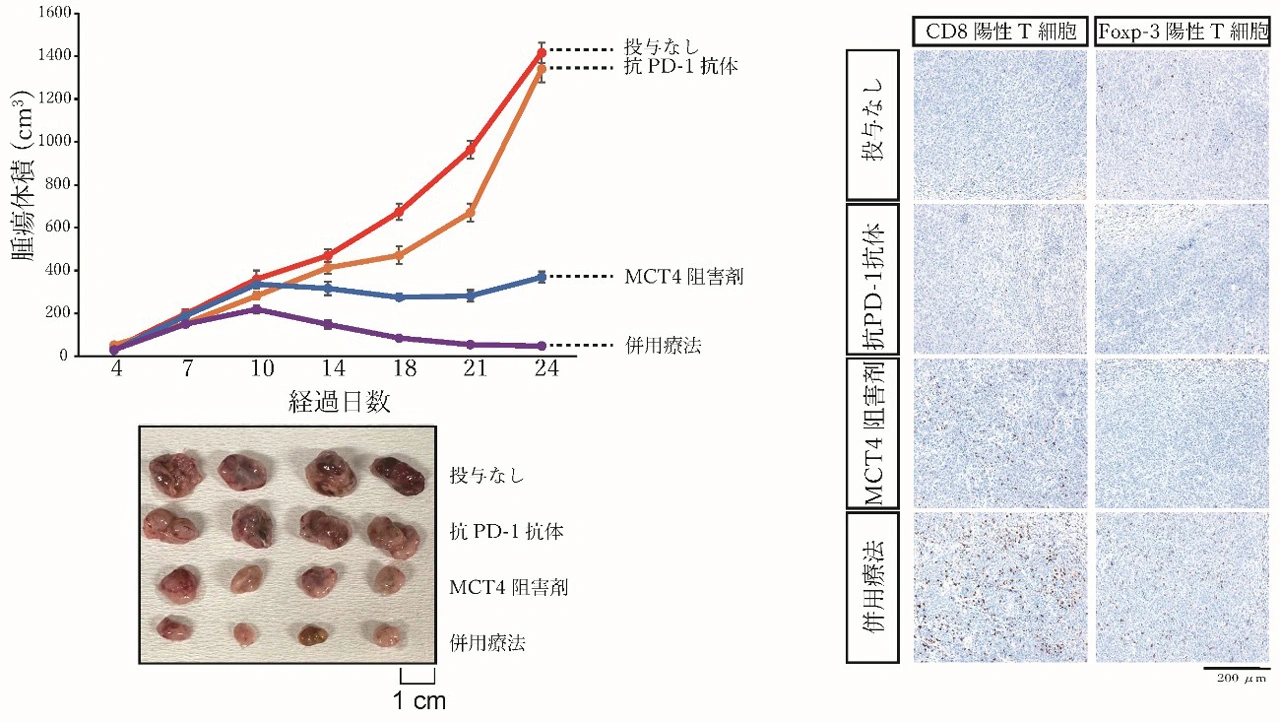
MCT4阻害剤の単独投与でも治療効果が認められるが、抗PD-1抗体との併用により、さらなる抗腫瘍効果が得られる。
社会的インパクト
現在、免疫チェックポイント阻害剤が肝がんの治療に導入されていますが、依然として難治性の症例が多く、新規治療法の開発が急務となっています。本研究では、肝がんの免疫治療抵抗性やTreg細胞の浸潤に関与する重要な分子機構を同定し、乳酸代謝を標的とした新たな肝がん治療アプローチの可能性を示しました。
さらに、PET-CT検査を用いることで、ACVR2Aの低発現、LDHAの高発現、およびTreg細胞の浸潤が顕著な肝がん症例を予測可能であることを明らかにしました。これにより、本治療戦略の適用対象を明確化する診断ツールとしての有用性が期待されます。
今後、本研究成果が臨床応用されれば、難治性肝がん患者に対する治療の選択肢が大きく広がることが期待されます。
今後の展開
肝がんは多様性が高い疾患であり、サブタイプに基づいた層別化と個別化医療の開発が求められています[参考文献3]。本研究では、非ウイルス性肝がんに多いTregサブタイプに対する治療戦略として、MCT4阻害剤の有効性を示し、抗PD-1抗体との併用療法が有望であることを明らかにしました。
現在、乳酸トランスポーター遺伝子(MCT遺伝子)を標的とした治療法としては、MCT1阻害剤の臨床試験が実施されているのみであり、本研究で用いたVB124の安全性はまだ確認されていません。今後は、臨床における有効性や安全性を検証し、MCT4阻害剤の開発および実用化が期待されます。
付記
本研究は文部科学省科学研究費助成事業(19H01055、20K21627、22K19554、22K08864、23H02979)、国立研究開発法人日本医療研究開発機構(AMED)「肝炎等克服実用化研究事業」および「次世代がん医療創生研究事業」(P-CREATE)、高松宮妃癌研究基金研究助成金などのもとに行われたものです。
- [1]
- Shimada S, Mogushi K, Akiyama Y, Furuyama T, Watanabe S, Ogura T, Ogawa K, Ono H, Mitsunori Y, Ban D, Kudo A, Arii S, Tanabe M, Wands JR, Tanaka S. (2019). Comprehensive molecular and immunological characterization of hepatocellular carcinoma. EBioMedicine, 40, 457-470. doi: 10.1016/j.ebiom.2018.12.058.
- [2]
- Watson MJ, Vignali PDA, Mullett SJ, Overacre-Delgoffe AE, Peralta RM, Grebinoski S, Menk AV, Rittenhouse NL, DePeaux K, Whetstone RD, Vignali DAA, Hand TW, Poholek AC, Morrison BM, Rothstein JD, Wendell SG, Delgoffe GM. (2021). Metabolic support of tumour-infiltrating regulatory T cells by lactic acid. Nature, 591, 645-651. doi: 10.1038/s41586-020-03045-2.
- [3]
- Taniai T, Shimada S, Akiyama Y, Hatano M, Yasukawa K, Igarashi Y, Tsukihara S, Tanji Y, Kodera K, Okazaki K, Haruki K, Nara A, Yagi K, Akahoshi K, Ban D, Asahina Y, Ikegami T, Tanabe M, Tanaka S. (2025). Comprehensive molecular and immunological characterization of hepatocellular carcinoma. Hepatology, in press. doi: 10.1097/HEP.0000000000001284.
用語説明
- [用語1]
- ACVR2A(アクチビンA受容体2A):細胞の増殖や分化を調節するTGF-βファミリーに対する受容体の一種。
- [用語2]
- 解糖系:細胞がグルコースを分解し、ATP(エネルギー)を産生する代謝経路。がん細胞では、酸素が存在しても解糖系が活性化し、大量の乳酸を生成する。
- [用語3]
- LDHA(乳酸脱水素酵素A):解糖系において、ピルビン酸を乳酸に変換する酵素。腫瘍細胞のエネルギー代謝に関与している。
- [用語4]
- MCT4(モノカルボン酸トランスポーター4):乳酸を細胞外に排出する輸送体。特に腫瘍細胞の代謝において重要な役割を果たす。
- [用語5]
- 制御性T細胞(Treg細胞):免疫応答を抑制し、自己免疫反応を防ぐT細胞の一種。腫瘍微小環境では、抗腫瘍免疫を抑制する働きを持つ。
- [用語6]
- 抗PD-1抗体療法:免疫チェックポイント阻害薬の一種である抗PD-1抗体を用い、PD-1を標的とすることでT細胞の抗腫瘍免疫を再活性化する治療法。
- [用語7]
- 細胞傷害性T細胞(CD8陽性T細胞):感染細胞や腫瘍細胞を直接攻撃するT細胞。
- [用語8]
- ノックアウト:特定の遺伝子を機能しないようにする遺伝子改変技術。
- [用語9]
- PET-CT検査(ポジトロン断層法-コンピュータ断層撮影):ポジトロン断層法(PET)とX線CTを組み合わせた画像診断法。腫瘍の位置や代謝活動を可視化できる。
論文情報
- 掲載誌:
- Cell Reports Medicine
- タイトル:
- ACVR2A attenuation impacts lactate production and hyperglycolytic conditions attracting regulatory T cells in hepatocellular carcinoma
- 著者:
- Koya Yasukawa, Shu Shimada, Yoshimitsu Akiyama, Tomohiko Taniai, Yosuke Igarashi, Shu Tsukihara, Yoshiaki Tanji, Kentaro Umemura, Atsushi Kamachi, Atsushi Nara, Masahiro Yamane, Keiichi Akahoshi, Akira Shimizu, Yuji Soejima, Minoru Tanabe, Shinji Tanaka
研究者プロフィール
田中 真二 Shinji TANAKA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 教授
研究領域:分子腫瘍医学、消化器外科学
島田 周 Shu SHIMADA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 助教
研究領域:分子腫瘍医学、バイオインフォマティクス
安川 紘矢 Koya YASUKAWA
東京科学大学 大学院医歯学総合研究科 分子腫瘍医学分野 大学院生
研究領域:分子腫瘍医学、消化器外科学